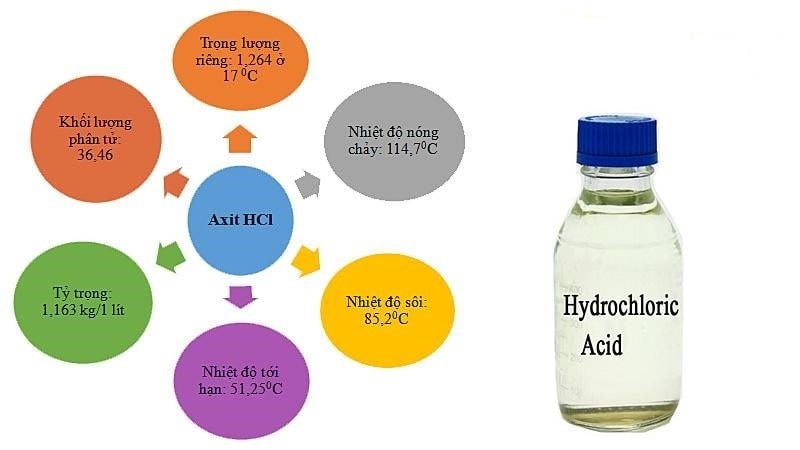
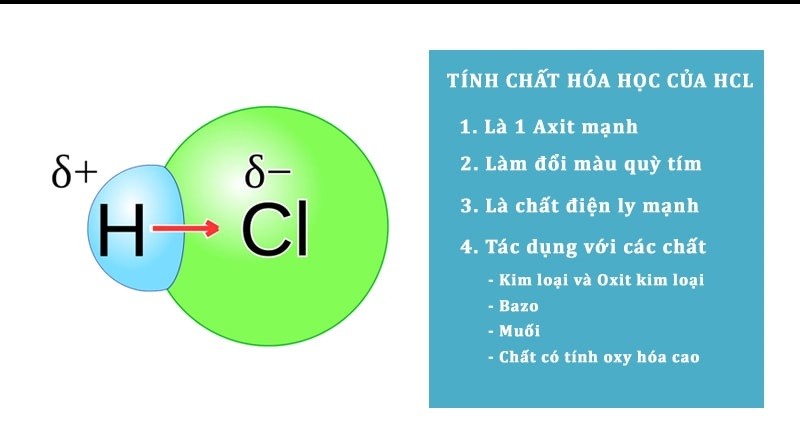
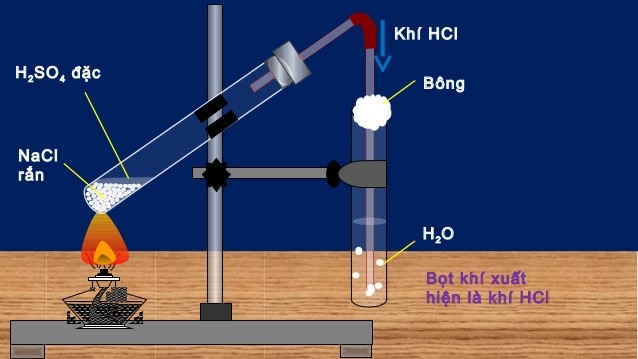
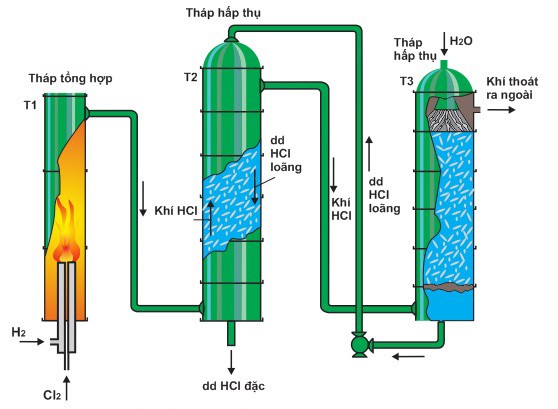
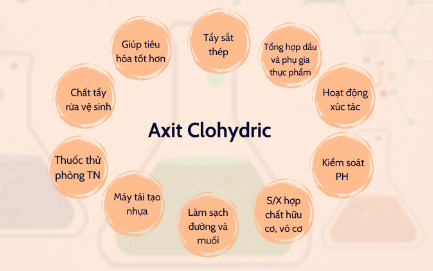
Axit CloHydric – 32%
– Chất lượng Axit Clohydric (HCl) được đảm bảo chính hãng và có giá thành tốt nhất trên thị trường hiện nay.
– Hệ thống chuyên viên tư vấn chuyên nghiệp với kiến thức sâu và luôn sẵn sàng hỗ trợ quý khách hàng 24/7.
– Nguồn gốc, xuất xứ của tất cả các mặt hàng đều rõ ràng, chính hãng 100% và được bảo hành theo đúng tiêu chuẩn của nhà sản xuất.
– Công ty hóa chất Đông A luôn cung cấp đầy đủ chứng từ, hóa đơn thanh toán khi giao nhận hàng
– Thủ tục thanh toán đơn giản, nhanh chóng.
Đặt mua Axit CloHydric – 32%

Axit CloHydric – 32%
Bạn vui lòng nhập đúng số điện thoại để chúng tôi sẽ gọi xác nhận đơn hàng trước khi giao hàng. Xin cảm ơn!





















Đánh giá
Chưa có đánh giá nào.